工作中,有没有遇到过模模糊糊、似懂非懂的时刻?其实有的问题,是因为对底层知识不够了解。
因此,针对医疗器械行业从业者,或者投资器械、想进入器械圈工作的朋友们,思宇MedTech开启了“械企必读”系列,旨在说清楚一些基本问题,帮助我们认识医疗器械产业全局,理解自己在产业中的位置,才更能想清楚战略性的问题和创新思路与方法。
比如,软件是“器械”么?宠物医疗器械是“医疗器械”么?康复辅具是“医疗器械”么? 请看 第1篇,到底什么是医疗器械?各国对医疗器械的定义有何不同?
今天分享各个角度的医疗器械分类,帮助我们理解自己在产业/产品中的位置。医疗器械的分类有多个维度。
当我们进行产品注册时,需熟悉法规中的产品目录分类,以及按风险划分的分类。
当我们研究医疗器械市场时,需了解每个赛道的含义和其包含的器械产品。
当我们研究未来科技趋势时,需掌握科学方向对应的临床需求,甚至是一些没有明确分类的产品。
01 中国医疗器械分类
一、分类依据相关的政策文件
《医疗器械监督管理条例》(2020年12月21日国务院第119次常务会议修订通过)
《医疗器械分类规则》(国家食品药品监督管理总局令第15号)
《体外诊断试剂分类规则》(国家食品药品监督管理总局2021年第129号)
关于发布医疗器械分类目录动态调整工作程序的公告(国家食品药品监督管理总局2021年第60号)
二、“依据影响医疗器械风险程度的因素,医疗器械可以分为以下几种情形:
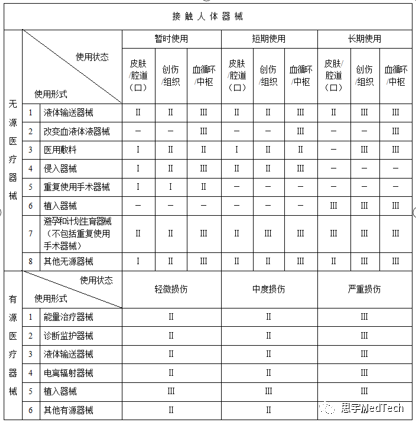
(一)根据结构特征的不同,分为无源医疗器械和有源医疗器械。
(二)根据是否接触人体,分为接触人体器械和非接触人体器械。
(三)根据不同的结构特征和是否接触人体,医疗器械的使用形式包括:
无源接触人体器械: 液体输送器械、改变血液体液器械、医用敷料、侵入器械、重复使用手术器械、植入器械、避孕和计划生育器械、其他无源接触人体器械。
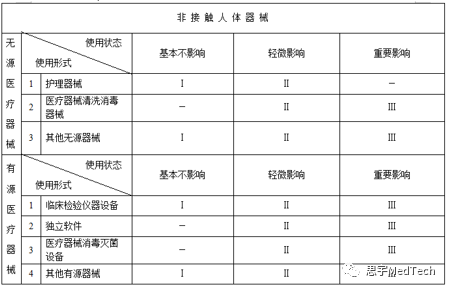
无源非接触人体器械: 护理器械、医疗器械清洗消毒器械、其他无源非接触人体器械。
有源接触人体器械: 能量治疗器械、诊断监护器械、液体输送器械、电离辐射器械、植入器械、其他有源接触人体器械。
有源非接触人体器械: 临床检验仪器设备、独立软件、医疗器械消毒灭菌设备、其他有源非接触人体器械。”
(四)根据不同的结构特征、是否接触人体以及使用形式,医疗器械的使用状态或者其产生的影响包括以下情形:
无源接触人体器械: 根据使用时限分为暂时使用、短期使用、长期使用;接触人体的部位分为皮肤或腔道(口)、创伤或组织、血液循环系统或中枢神经系统。
无源非接触人体器械: 根据对医疗效果的影响程度分为基本不影响、轻微影响、重要影响。
有源接触人体器械: 根据失控后可能造成的损伤程度分为轻微损伤、中度损伤、严重损伤。
有源非接触人体器械: 根据对医疗效果的影响程度分为基本不影响、轻微影响、重要影响。”
名词解释:
无源医疗器械: 不依靠电能或者其他能源,但是可以通过由人体或者重力产生的能量,发挥其功能的医疗器械。
有源医疗器械: 任何依靠电能或者其他能源,而不是直接由人体或者重力产生的能量,发挥其功能的医疗器械。
独立软件: 具有一个或者多个医疗目的,无需医疗器械硬件即可完成自身预期目的,运行于通用计算平台的软件。这一类也是医疗器械)
三、按《医疗器械分类规则》(国家食品药品监督管理总局令第15号)中的大类
有源手术器械
无源手术器械
神经和心血管手术器械
骨科手术器械
放射治疗器械
医用成像器械
医用诊察和监护器械
呼吸、麻醉和急救器械
物理治疗器械
输血、透析和体外循环器械
医疗器械消毒灭菌器械
有源植入器械
无源植入器械
注输、护理和防护器械
患者承载器械
眼科器械
口腔科器械
妇产科、辅助生殖和避孕器械
医用康复器械
中医器械
医用软件
临床检验器械
四、按监管的风险分类
内容详情见《医疗器械监督管理条例》国令第739号。其中对医疗器械注册与备案、生产、经营与使用、召回、监督检查进行了规定。
1.第一类是风险程度低 ,实行常规管理可以保证其安全、有效的医疗器械。如:外科用手术器械(刀、剪、钳、镊、钩)、刮痧板、医用X光胶片、手术衣、手术帽、检查手套、纱布、绷带、引流袋等。
第一类需向地市药监局提交备案资料。 备案依据《第一类医疗器械产品目录》
2.第二类是具有中度风险 ,需要严格控制管理以保证其安全、有效的医疗器械。如医用缝合针、血压计、体温计、心电图机、脑电图机、显微镜、针灸针、生化分析系统、助听器、超声消毒设备、不可吸收缝合线等。
第二类需向省级药监局提交注册申请。
3.第三类是具有较高风险 ,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。植入式心脏起搏器、角膜接触镜、人工晶体、超声肿瘤聚焦刀、血液透析装置、植入器材、血管支架、综合麻醉机、齿科植入材料、医用可吸收缝合线、血管内导管等。
第三类需向国家药监局提交注册申请。
补充的分类原则:
(一)如果同一医疗器械适用两个或者两个以上的分类,应当采取其中风险程度最高的分类;由多个医疗器械组成的医疗器械包,其分类应当与包内风险程度最高的医疗器械一致。
(二)可作为附件的医疗器械,其分类应当综合考虑该附件对配套主体医疗器械安全性、有效性的影响;如果附件对配套主体医疗器械有重要影响,附件的分类应不低于配套主体医疗器械的分类。
(三)监控或者影响医疗器械主要功能的医疗器械,其分类应当与被监控、影响的医疗器械的分类一致。
(四)以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理。
(五)可被人体吸收的医疗器械,按照第三类医疗器械管理。
(六)对医疗效果有重要影响的有源接触人体器械,按照第三类医疗器械管理。
(七)医用敷料如果有以下情形,按照第三类医疗器械管理,包括:预期具有防组织或器官粘连功能,作为人工皮肤,接触真皮深层或其以下组织受损的创面,用于慢性创面,或者可被人体全部或部分吸收的。
02 市场视角的医疗器械分类
一、按临床科室分类
如:IVD、影像、心血管、骨科、普外科、眼科、神经外科等。
二、按产品形态和属性分类
1.高值医用耗材(血管介入、电生理、骨科、眼科、口腔科、神经外科、其他介入类);、
2.低值医用耗材(医用卫生材料及敷料、注射穿刺类、医用高分子材料类、医用消毒类、麻醉耗材类、手术室耗材类、医技耗材类)
3.医疗设备
(1)诊断设备、治疗设备、生命支持设备、医用监视器/监护仪;
(2)医学实验室检测设备;
(3)家用医疗设备,等
4.IVD体外诊断
03 国外医疗器械分类
对于医疗器械企业来说,我们最常接触的是监管风险的分类,即常说的一类、二类、三类。因为这是我们产品上市必经的一环。从风险分类上,美国、欧盟、日本,跟中国类似。
一、美国
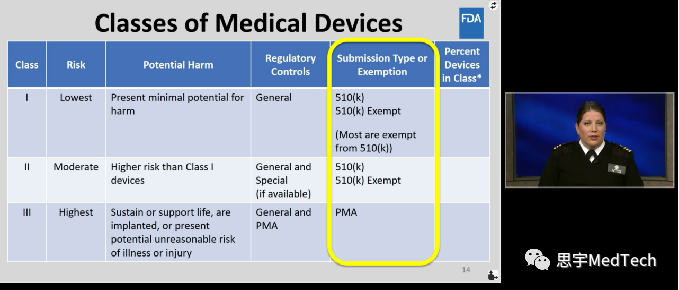
在美国, 医疗器械(Medical Device)分为I类、II类、III类,其中I类风险最低。
关于医疗器械产品选择什么分类,如何注册,FDA(美国食品药品监督管理局)官方有视频教程,在CDRH Learn中,链接:
https://www.fda.gov/training-and-continuing-education/cdrh-learn
对于大家常听说的510k,亦有详细说明。
二、欧盟
医疗器械分为 I类、IIa类、IIb类、III类,其中 I类风险最低
在欧盟申请CE认证,器械厂商可以阅读此说明
https://ec.europa.eu/growth/single-market/ce-marking/manufacturers_en
系列文件所在网页:
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:02017R0745-20170505
三、日本
在日本,医疗器械分为 I类、II类、III类、IV类,其中I类风险最低。
日本负责监管器械的是厚生劳动省,该部门是负责日本医疗卫生和社会保障的主要部门,设有11个局7个部门,主要负责日本的国民健康、医疗保险、医疗服务提供、药品和食品安全、社会保险和社会保障、劳动就业、弱势群体社会救助等职责。